항암분야 신약 국내 최초..국내 공장생산 최초 승인
국내 여섯번째 FDA 시판허가 신약
[포쓰저널] 한미약품의 첫 글로벌 신약이 세계 최대 제약 시장인 미국에서 시판된다.
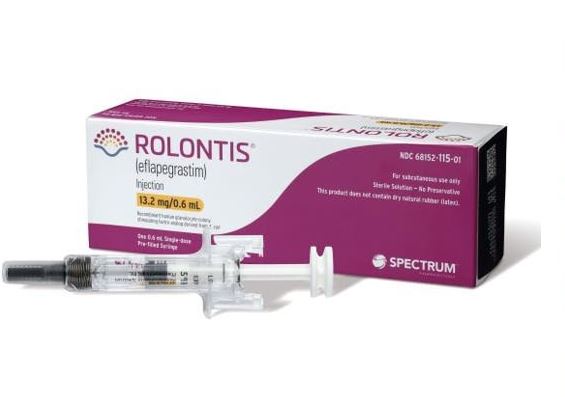
한미약품은 파트너사 스펙트럼이 10일(미국 시간 9일) 미국 식품의약국(FDA)으로부터 호중구 감소증 치료 바이오신약 '롤론티스'(미국명:롤베돈 ROLVEDON)에 대한 시판을 승인하는 통지문을 받았다고 밝혔다.
이번 FDA의 시판허가는 한미약품이 개발한 신약 중 처음이다. 항암 분야 신약으로도 국내 최초 사례다.
특히 FDA 실사를 통과한 국내 공장(한미약품 평택 바이오플랜트)에서 생산해 FDA 허가를 받아 미국 시장으로 진출하는 한국 최초의 바이오신약이기도 하다.
한국 제약업계 전체로는 여섯번째 FDA 신약 시판허가 사례다.
한미약품이 2012년 미국 제약사 스펙트럼에 기술수출(라이선싱 아웃)한지 약 10년 만이다.
한미약품과 스펙트럼은 롤론티스의 성공적 미국 시장 론칭을 위한 준비를 이미 시작했으며, 미국 전역으로 확대한 영업 네트워크를 토대로 연내 최대한 신속히 미국 시장에 제품을 출시할 계획이다. 미국의 호중구 감소증 치료제 시장 규모는 약 3조원대 규모로 알려졌다.
한미약품 대표이사 권세창 사장은 “한미약품 신약 중 첫 FDA 허가 사례일 뿐 아니라, 한미의 독자적 플랫폼 기술인 ‘랩스커버리’의 상용화 가능성을 입증했다는 데 큰 의미가 있다”며 “롤론티스의 상업적 성공 및 랩스커버리 기반 바이오신약들의 미래가치 동반상승의 결정적 계기가 될 것으로 기대한다”고 말했다.
롤론티스는 항암 치료 등으로 인해 백혈구 내 호중구가 비정상적으로 감소한 암 환자에 쓰는 치료제로 지난해 3월 식품의약품안전처로부터 국산 신약 33호로 허가받았다. 한미약품의 약효 지속력을 키운 '랩스커버리' 플랫폼 기술로 주사제로 개발됐다.
한미약품은 2012년 스펙트럼에 기술을 이전한 뒤 공동으로 개발해 왔다. 2018년 말 미국 FDA에 롤론티스의 품목허가를 처음 신청한 이후 올해 3월 재신청했고, 미국 FDA는 6월 롤론티스의 원액 생산을 담당하는 한미약품의 평택 바이오플랜트에 대한 실사를 진행했다. 한미약품의 스펙트럼 지분율은 약 10%대다.
현재까지 미국에서 허가된 국내 신약은 △2003년 LG생명과학(현 LG화학)의 항생제 '팩티브(2003년)' △2014년 동아에스티의 항생제 '시벡스트로' △2016년 SK케미칼의 혈우병치료제 '앱스틸라' △2019년 SK바이오팜의 '수노시·엑스코프리' 등 5개다. 이번 '롤론티스'까지 6개로 늘었다.
한미약품이 앞서 스펙트럼에 기술수출했던 항암신약물질 '포지오티닙'도 11월 24일 내 FDA의 최종 허가 여부를 기다리고 있다.